正规炒股合法配资
热点资讯
- 股票扛杆 医保部门将多措并举加大对定点零售药店监管
- 炒股如何配资 一场同学聚会让我看清,考公和进名企的区别,幸好当初没选错
- 加杠杆买股票 苹果:在经历三季度业绩不平衡之后,预计AI功能将带来提振
- 平台配资 成功着陆!嫦娥六号将实施人类首次月背采样返回
- 股票配资到哪家好 韩国KOSPI指数涨幅收窄至3.5%
- 正规股票配资论坛 上证城投债指数报238.77点
- 炒股杠杆是啥意思 华正新材(603186)8月20日主力资金净卖出3162.20万元
- 股票4倍杠杆 【12315投诉公示】消费者投诉江山欧派冒充合格产品问题
- 配资杠杆平台有十倍杠杆吗 每日网签 | 6月1日北京新房网签137套 二手房网签86套
- 潜山县股票配资 国家卫健委:我国儿童健康核心指标持续向好 优于全球中高收入国家平均水平
- 发布日期:2024-07-28 20:49 点击次数:86
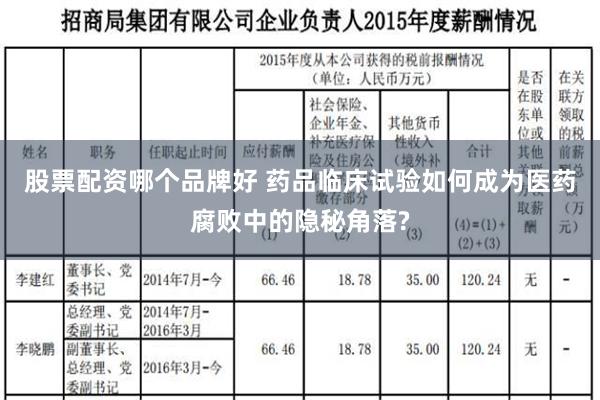
5月27日,国家卫健委官网发布公告,国家卫健委在内的14部委联合制定印发了《关于印发2024年纠正医药购销领域和医疗服务中不正之风工作要点的通知》,继续推进全国医药领域腐败问题集中整治。
此次的医疗反腐,紧盯项目招采、目录编制、价格确定、项目申请、新药申报、回款结算等权力集中、资金密集、资源富集的医药领域风险,严查假借各类会议、捐赠资助、科研合作、试验推广等形式捆绑销售、“带金销售”中的违法违规行为。医疗反腐的聚光灯早已不再只关注药品回扣、收受红包,而是拓展到医疗领域链条的方方面面。
药品临床试验虽然是医疗行业中大众鲜有人知的一个领域,但实际上药品临床试验阶段所存在的腐败与权力寻租问题早有暴露。2020年,上海市公共卫生临床中心药物临床试验机构办公室原主任、新药临床研究中心原主任顾俊利用职权之便收受贿赂达150余万元,就曾揭开临床试验腐败的一角。
一款新药想要上市,必须先经过临床试验。然而临床试验复杂且漫长,根据全球经验,临床试验从启动到完成一般需要4-6年,平均成本超过10亿元,时间和资金投入在整个新药研发中占六七成左右。
因此,在一些寻求快速推进临床试验的药企,与掌握优质医疗资源的专家与医疗机构之间,便滋生了新的腐败。
临床试验腐败空间从何而来?
“只要是能够影响临床试验进度的节点,都有利润空间。”一位药企内部人士王磊(化名)如是告诉界面新闻。
一款新药在上市前必须进行临床试验,而临床试验机构是必不可少的合作对象。一般而言,药企想要开展一项临床试验,需要历经层层繁琐而不可少的环节,大致可以分为选择合作的医院、项目调研、立项审核、伦理审查与协议预审核、遗传办审批与协议OA审批签署、启动会备案等。
“药企选择临床试验机构一般比较看重机构的病源量。像一些大型肿瘤医院,患者入组速度比较快,一些药企为了加快药品上市,更愿意选择这样的医院。”在一家CRO(合同研发组织)公司工作的薛勤(化名)告诉界面新闻。
而一位临床试验业内人士则称,药企在选择临床试验机构时,根据药品情况会有不同的选择,有的药品追求上市速度,有的药品追求上市质量,有的药品则看重后面的市场销售有专家“代言”等,会根据不同药品情况进行不同的选择。
不过,也有一些药企在其中的目的并不单纯,简单来说便是,一些临床试验是不是真的应该做,是为了回答科学问题还是进行利益输送?
一名知名外企研发部门负责人称,“外企做临床试验的原因大多是公司分析内部数据有缺口,需要一些研究来弥补,但也有一些药企看哪个医生需要搞定,会通过砸钱做研究的方式实现。”
然而,对于真正想做研究的药企来说,不管是病源量、还是专家“代言”,都集中于几家头部的临床试验机构,以至于部分药企削尖了脑袋想要挤进这些头部机构。
根据药研社发布的《2022年全国注册药物临床试验概览》,2022年新承接注册类药物临床试验数量最多的前3家药物临床试验机构分别为,四川大学华西医院344个、华中科技大学同济医学院附属协和医院308个、河南省肿瘤医院293个。而2022年在CDE(国家药品监督管理局药品审评中心)上新增登记公示的药物临床试验共计3316个。计算可知,前3家临床试验机构承接项目的数量占掉了总数的近三成。
不过,据众成数科统计,2022年共有1186家临床试验机构。临床试验市场呈现出“倒三角”趋势,少数机构包揽了多数项目。
每个医院的临床试验机构在一段时间内能够承接的项目有一定限制,但是同一时间内就同一靶点想要进行药物试验的药企不在少数,同质化竞争严重。王磊告诉界面新闻,“这么多家药企都想要挤进同一家临床试验机构,这时主动权就在临床试验机构手上,临床试验机构选择哪些药企不选哪些药企,就是拼谁给的好处多了。”
前述上海市公共卫生临床中心新药临床研究中心原主任顾俊就曾通过提前药品临床试验排期、违规从事药物临床试验等方式,多次收受包括重庆恒真维实医药科技有限公司、天津凯莱英医药科技有限公司在内20家药企的贿赂款共150余万元,并收受多家公司干股。
而在药企与临床试验机构签订合同、完成备案之后,开始临床试验的第一件事是招募患者入组。不过,针对同一靶点的药物试验,满足试验的患者总数有限。对于药企而言,患者进组的快慢极有可能影响药物上市的快慢,最终影响药物能否第一时间抢占市场。
于是“推荐费”便产生了。一些药企为了争取患者优先或者加速入组,会给医生一笔“推荐费”。“一个患者入组,医生可以拿几千到几万块不等的推荐费,以此类推。”多位业内人士告诉界面新闻。上述CRO内部人士薛勤称,甚至有的医生会主动要“推荐费”。
药企开展临床试验必须和医院合作的原因之一是医院掌握丰富的患者资源,国浩律师 (天津) 事务所律师张永泉告诉界面新闻,“患者资源不走招投标,这是外部制约的一个盲点。对于医院而言,多个项目都在竞争同一批患者,那么,患者能不能顺利入组就要看药企的表现。”
除了“推荐费”之外,在招募患者这一环节,还有其他渔利空间。药企作为申办方和临床试验中心签订合同时,会写明这个项目花费的资金,其中一笔钱是给医生的劳务费,还有一笔钱是给患者的交通补贴和营养补贴。张永泉称:“实际上,部分机构会把给患者的补贴扣下,项目结束后将这部分补贴瓜分。”
一名曾参与过填充颈纹相关临床试验的患者告诉界面新闻,至今她参与的项目已经结束两年,但是其仍未收到合同上规定的补贴,询问曾负责该项目的CRA(临床监查员),对方称早已离职。
《新京报》曾有报道称,在一次试验中,一名受试者发现药厂给每个受试者的费用超过3万元,但医生让他们签的知情同意书上的报酬是2500元。这意味着中间的差价被医院和中介盘吞掉了。
王磊还告诉界面新闻,“一些机构称给患者的交通补贴和营养补贴会让患者先自费,之后再由桓机构报销。在报销过程中,假如患者花了一万,那么机构报账的时候就会报两万,这中间的差价就成为机构的‘收益’。”
“人情世故”
在临床试验进行过程中,药企的“打点”次数也不算少。根据2018年的一封刑事判决书,河南省人民医院药学部党总支书记秦玉花,曾收受江苏正大天晴药业公司河南片区经理陈某3万元。
据陈某陈述,其在2012年-2017年每年春节前,都会去秦玉花办公室,分6次给她送去现金3万元,每次0.5万元。而陈某之所以给秦玉花送这3万元,是因为秦是河南省人民医院药学部主任,负责监管药物实验的真实性、安全性,该公司的药品能否顺利通过实验验收,秦玉花有较大话语权;另外公司的药品出现不良反应,需要秦协调解决。河南省人民医院使用该公司的药品有异甘酸镁注射液等10几种。他们公司的药品在上市前三期实验中,都顺利通过国家验收,秦玉花没有给公司出难题。在公司药品使用中出现不良反应,秦玉花会及时反馈情况,让公司及时查明情况解决问题,没难为过他们公司。
2022年,上海市监局发布一则行政处罚,江苏礼华生物技术有限公司“贿赂交易相对方工作人员”,处以罚款10万元。处罚决定书显示,江苏礼华生物技术有限公司是一家临床CRO公司,主要业务为接受药品生产企业的委托,与药物临床试验机构开展药物临床试验。
经市监部门调查,2018年1月,该公司现法定代表人夏燕(时任职务为医学总监)为了维护与时任某医院新药临床研究中心主任顾某的关系,感谢其在富马酸替诺福韦二吡呋酯片人体生物等效性研究项目开展中给予的关照,同时希望在后续的富马酸喹硫平片项目中提供帮助,向顾某赠送了现金人民币2万元。自2017年7月至2018年4月,江苏礼华生物技术有限公司开展的两个项目富马酸替诺福韦二吡呋酯片及富马酸喹硫平片项目实际支付660.91万元。
上海市金山区市场监督管理局认为,江苏礼华生物技术有限公司的上述行为违反《中华人民共和国反不正当竞争法》第七条第一款第(一)项的规定,构成了商业贿赂的行为。
临床试验进程一步步推进,到了药品审批上市的环节,药企行贿的对象发生了改变。据2017年的一纸刑事裁定书,原国家药品监督管理局药品注册司生物制品处处长、原国家食品药品监督管理局药品注册司生物制品处处长尹红章于2003年至2005年间,接受浙江天元生物药业股份有限公司原董事长丁某的请托,为该公司在药品申报审批事宜上提供帮助,非法收受丁某给予的价值人民币18万余元的象牙制品一根。
不难发现,临床试验涉及到的贿赂金额一般较小,患者入组给点“推荐费”、项目通过给点“好处”等等,往往是中国传统意义上的“给钱好办事”。然而,这种帮忙有多少成分是因为送了礼,有多少成分是其本身职责所在?
多名业内人士告诉界面新闻,医生愿意做临床试验的原因有两个,一是研究费用客观,二是研究成果可以发表。薛勤也说,“大部分研究者或者医生更看中的是学术成果而不是那点儿钱,这个成果可以帮他扩大学术影响力,对他们来说更重要。”
而对于药企来说,上述知名外企研发部负责人称,“从研究目的出发还是从客情出发,药企内部有明确的研究准则,是不允许商业来干扰研究立项和操作的。”
“有人有钱的地方就有腐败,这是资本的属性,不是临床试验的属性,也不是医药行业的特有属性。”上述临床机构业内人士如是说到。
野蛮生长的临床试验
除了临床试验中收受贿赂的灰色地带,试验不规范是临床试验目前发展最突出的问题。
“临床研究协调员都是大专或本科毕业生,也没有受过严格培训,他怎么知道临床研究怎么做?”在《2023年抗肿瘤创新药物临床研究论坛》上,中国临床肿瘤学会(CSCO)副理事长秦叔逵直指临床试验乱象。
秦叔逵提到的临床研究协调员(CRC),是一个外来工种,最早出现在美国。最早在临床试验过程中,研究者、药剂师等各司其职,难以应对繁琐而严谨的临床试验流程,CRC便应运而生,作为研究者(PI)的助手负责临床试验中项目管理与协调等非医学判断的工作。
而我国CRC大量出现的背后是临床试验机构的爆炸性增长。
根据2021年全球医药智库信息平台Informa Pharma Intelligence发布的白皮书《中国临床试验格局》,自2016年以来,中国启动的临床试验数量由2016年的1785项增至2020年的3641项,年均增长率约为20%。2016年至2020年的五年时间,被称为临床试验市场发展的“黄金时期”。
政策利好、创新药物研发加速、临床需求提升,多种因素刺激临床试验市场的发展。许俊才曾撰文写到,“在资本的推动下,中国制药行业的me faster(更快研发出的同类药)与me too(仿创)的新药开发模式出现,产生了一大批的临床试验项目,造成著名GCP(药物临床试验质量管理规范)机构和业内有名望的教授成为制药企业争抢的对象。”
王磊也告诉界面新闻,一个大PI往往身兼数个项目,没有足够的时间和精力亲历亲为,很多本该由PI负责的开医嘱、写病历等工作也由CRC“代劳”。事实上,《药物临床试验质量管理规范》中清楚写到,“凡涉及医学判断或临床决策应当由临床医生做出。”
除此之外,一些临床试验中的患者并不满足入组要求。一位知名医学院的医学生对界面新闻说:“一些试药的志愿者大多来自和药企有关联的私立医院,符合要求的志愿者很少。比如一个肿瘤药物试验,限制试药志愿者必须是出现某些症状的患者,但实际上,因为试验要大量样本,一些正常人或者有这种肿瘤但是没有这些症状的患者也会被允许入组。这些正常人中有一些是药企员工。”
早在2016年,《新京报》就对此问题进行过报道,“进行药物临床试验时弄虚作假,特别是体检时蒙混过关,在受试者这个群体中,已是见怪不怪。”
王磊还说:“临床试验项目对于患者来说,具有非常大的信息差。一个PI手上有好几个类似的项目,患者能进哪个项目不是患者可以决定的,而且患者本身对于不同项目的差别也不清楚。很多临床中心对于患者的管理也不规范,比如即使是随机双盲试验(测验者与被测验者都不知道被测者所属的组别,意在消除主观偏差),医生也会随意干涉入组,给自己认识的患者挑挑拣拣。”
《中国新闻周刊》曾报道,安徽省立医院医生彭真等人分析了“7·22”后某医疗机构开展的32个临床试验,发现其中29个项目合计存在387个不合格点,该研究于2021年3月份发表在《中国医院药学杂志》。具体来说,问题最多的是临床试验过程记录及临床检查、化验等数据的溯源方面,存在不合格项270项,占比69.77%,其余不合格的事项包括受试者的筛选/入组相关数据链完整性,临床试验的生物样本采集、保存、运送与交接记录等。
张永泉讲到:“临床试验乱象频出的主要原因是国家对于临床试验没有严格的监管,没有程序性的规制,所以现在属于野蛮生长状态。”
而在秦叔逵公开批评临床试验后不久,2023年7月27日,CDE连发三项指导原则——《以患者为中心的药物临床试验设计技术指导原则(试行)》、《以患者为中心的药物临床试验实施技术指导原则(试行)》、《以患者为中心的药物获益-风险评估技术指导原则(试行)》。
三项指导原则从项目设计、实施、评估三方面对临床试验做出规定,强调“以患者为中心”,即基于患者角度开展的药物开发、设计、实施和决策的过程,旨在高效研发更符合患者需求的有临床价值的药物。
在患者招募环节,文件提出要基于患者需求的招募,应尽可能的让有需求的受试者发现适合的临床试验,并保证基于潜在受试者的需求和最佳获益-风险考虑而入组。并采用患者易于接受的知情同意方式等。
而在2023年7月初,先是国家药监局综合司公开征求《药物临床试验机构监督检查办法(试行)(征求意见稿)》意见,后是国家药监局核查中心发布《药物临床试验机构监督检查要点和判定原则(征求意见稿),作为上述检查办法的配套文件实施。
近些时间以来,国家药监局接连发布多个文件,对临床试验管理趋严股票配资哪个品牌好,临床试验乱象能否整治一空?在上述临床试验业内人士看来:“最重要的是医疗机构需要发挥研究者的作用,承担责任,而不是只牵头、开会,签字等。”